Đề cương ôn tập kiểm tra 1 tiết môn Hóa học Lớp 9 - Bài: Bazo và muối - Lê Hoàng Nam
Một số dung dịch có màu đặc trưng:
✓ Màu xanh lam: hợp chất muối Cu (II)
✓ Màu xanh lục nhạt: hợp chất muối Fe (II)
✓ Màu nâu đỏ: hợp chất muối Fe (III)
✓ Không màu: muối Al, muối Zn, muối Mg, muối Ag, muối Na,K.
✓ Màu xanh lam: hợp chất muối Cu (II)
✓ Màu xanh lục nhạt: hợp chất muối Fe (II)
✓ Màu nâu đỏ: hợp chất muối Fe (III)
✓ Không màu: muối Al, muối Zn, muối Mg, muối Ag, muối Na,K.
Bạn đang xem tài liệu "Đề cương ôn tập kiểm tra 1 tiết môn Hóa học Lớp 9 - Bài: Bazo và muối - Lê Hoàng Nam", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề cương ôn tập kiểm tra 1 tiết môn Hóa học Lớp 9 - Bài: Bazo và muối - Lê Hoàng Nam
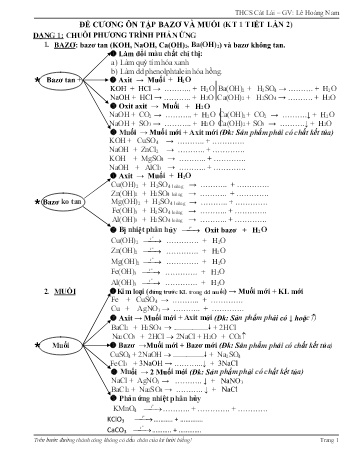
THCS Cát Lái – GV: Lê Hoàng Nam Trên bước đường thành công không có dấu chân của kẻ lười biếng! Trang 1 ĐỀ CƯƠNG ÔN TẬP BAZƠ VÀ MUỐI (KT 1 TIẾT LẦN 2) DẠNG 1: CHUỖI PHƯƠNG TRÌNH PHẢN ỨNG 1. BAZƠ: bazơ tan (KOH, NaOH, Ca(OH)2, Ba(OH)2) và bazơ không tan. Làm đổi màu chất chỉ thị: a) Làm quỳ tím hóa xanh b) Làm dd phenolphtalein hóa hồng. Bazơ tan + Axit → Muối + H2O KOH + HCl → .. + H2O Ba(OH)2 + H2SO4 → . + H2O NaOH + HCl → .. + H2O Ca(OH)2 + H2SO4 → . + H2O Oxit axit → Muối + H2O NaOH + CO2 → .. + H2O Ca(OH)2+ CO2 → .↓ + H2O NaOH + SO3 → .. + H2O Ca(OH)2 + SO3 → .↓ + H2O Muối → Muối mới + Axit mới (Đk: Sản phẩm phải có chất kết tủa) KOH + CuSO4 → .. + . NaOH + ZnCl2 → .. + . KOH + MgSO4 → .. + . NaOH + AlCl3 → .. + . Axit → Muối + H2O Cu(OH)2 + H2SO4 loãng → .. + . Zn(OH)2 + H2SO4 loãng → .. + . Bazơ ko tan Mg(OH)2 + H2SO4 loãng → .. + . Fe(OH)3 + H2SO4 loãng → .. + . Al(OH)3 + H2SO4 loãng → .. + . Bị nhiệt phân hủy ⎯→⎯ ot Oxit bazơ + H2O Cu(OH)2 ⎯→⎯ ot . + H2O Zn(OH)2 ⎯→⎯ ot . + H2O Mg(OH)2 ⎯→⎯ ot . + H2O Fe(OH)3 ⎯→⎯ ot . + H2O Al(OH)3 ⎯→⎯ ot . + H2O 2. MUỐI Kim loại (đứng trước KL trong dd muối) → Muối mới + KL mới Fe + CuSO4 → .. + . Cu + AgNO3 → .. + . Axit → Muối mới + Axit mới (Đk: Sản phẩm phải có ↓ hoặc) BaCl2 + H2SO4 → .................. + 2HCl Na2CO3 + 2HCl → 2NaCl + H2O + CO2 Muối Bazơ →Muối mới + Bazơ mới (Đk: Sản phẩm phải có chất kết tủa) CuSO4 + 2NaOH → ................ + Na2SO4 FeCl3 + 3NaOH → ...↓ + 3NaCl Muối → 2 Muối mới (Đk: Sản phẩm phải có chất kết tủa) NaCl + AgNO3 → .. ↓ + NaNO3 BaCl2 + Na2SO4 → .. ↓ + NaCl Phản ứng nhiệt phân hủy KMnO4 ⎯→⎯ ot .. + . + KClO3 ⎯→⎯ ot .. + . CaCO3 ⎯→⎯ ot .. + . THCS Cát Lái – GV: Lê Hoàng Nam Trên bước đường thành công không có dấu chân của kẻ lười biếng! Trang 2 Câu 1: Hoàn thành các chuỗi phương trình phản ứng sau: 1) FeCl3 (1)⎯⎯→ Fe(OH)3 (2)⎯⎯→ Fe2(SO4)3 (3)⎯⎯→ FeCl3 (4)⎯⎯→ Fe2(NO3)3 (5)⎯⎯→Fe(OH)3 . . 2) CuO (1)⎯⎯→ CuCl2 (2)⎯⎯→ Cu(NO3)2 (3)⎯⎯→Cu(OH)2 (4)⎯⎯→ CuSO4 (5)⎯⎯→ CuCl2 . . 3) Al2O3 (1)⎯⎯→ AlCl3 (2)⎯⎯→ Al(NO3)3 (3)⎯⎯→ Al(OH)3 (4)⎯⎯→ Al2O3 (5)⎯⎯→ Al2(SO4)3 . . 4) ZnO (1)⎯⎯→ ZnSO4 (2)⎯⎯→ Zn(NO3)3 (3)⎯⎯→ Zn(OH)2 (4)⎯⎯→ ZnCl2 (5)⎯⎯→ Zn(NO3)2 . . 5) MgO (1)⎯⎯→ MgSO4 (2)⎯⎯→ MgCl2 (3)⎯⎯→ Mg(OH)2 (4)⎯⎯→ MgO (5)⎯⎯→Mg(NO3)2 . . 6) ZnCl2 (1)⎯⎯→ Zn(OH)2 (2)⎯⎯→ ZnSO4 (3)⎯⎯→ Zn(NO3)2 (4)⎯⎯→ Zn(OH)2 (5)⎯⎯→ZnO . . 7) FeCl3 (1)⎯⎯→ Fe(OH)3 (2)⎯⎯→ Fe2O3 (3)⎯⎯→ Fe2(SO4)3 (4)⎯⎯→ Fe(OH)3 (5)⎯⎯→ Fe(NO3)3 . . 8) FeCl3 (1)⎯⎯→ Fe(OH)3 (2)⎯⎯→Fe2O3 (3)⎯⎯→ Fe2(SO4)3 (4)⎯⎯→ FeCl3 (5)⎯⎯→ Fe(NO3)3 . . THCS Cát Lái – GV: Lê Hoàng Nam Trên bước đường thành công không có dấu chân của kẻ lười biếng! Trang 3 DẠNG 2: MÔ TẢ HIỆN TƯỢNG VÀ VIẾT PHƯƠNG TRÌNH PHẢN ỨNG Một số lưu ý khi làm bài: • Một số dung dịch có màu đặc trưng: ✓ Màu xanh lam: hợp chất muối Cu (II) ✓ Màu xanh lục nhạt: hợp chất muối Fe (II) ✓ Màu nâu đỏ: hợp chất muối Fe (III) ✓ Không màu: muối Al, muối Zn, muối Mg, muối Ag, muối Na,K. • Một số chất kết tủa có màu: ✓Màu trắng:BaSO4↓,CaCO3↓,CaSO3↓, AgCl↓ ✓Màu xanh: Cu(OH)2↓. ✓Màu lục nhạt: Fe(OH)2↓. ✓ Màu nâu đỏ: Fe(OH)3↓. ✓ Keo trắng: Al(OH)3↓, Zn(OH)2↓, Mg(OH)2↓ Câu 2: Nêu hiện tượng xảy ra và viết phương trình hóa học trong các thí nghiệm sau: 1) Cho dung dịch axit clohidric vào ống nghiệm chứa dung dịch Na2CO3. ........................................................................................................................................................... ........................................................................................................................................................... 2) Cho dung dịch axit clohidric vào ống nghiệm chứa dung dịch Na2SO3. ........................................................................................................................................................... ........................................................................................................................................................... 3) Cho dung dịch natri hidroxit vào ống nghiệm chứa dung dịch CuSO4. ........................................................................................................................................................... ........................................................................................................................................................... 4) Cho dung dịch natri hidroxit vào ống nghiệm chứa dung dịch FeCl2. ........................................................................................................................................................... ........................................................................................................................................................... 5) Cho dung dịch natri hidroxit vào ống nghiệm chứa dung dịch FeCl3. ........................................................................................................................................................... ........................................................................................................................................................... 6) Cho dung dịch natri hidroxit vào ống nghiệm chứa dung dịch ZnSO4. ................................................................................................................................................................ ................................................................................................................................................................ 7) Cho dung dịch bạc nitrat vào ống nghiệm chứa dung dịch MgCl2 . ................................................................................................................................................................ ................................................................................................................................................................ 8) Cho dung dịch bạc nitrat vào ống nghiệm chứa dung dịch ZnCl2 . ................................................................................................................................................................ ................................................................................................................................................................ THCS Cát Lái – GV: Lê Hoàng Nam Trên bước đường thành công không có dấu chân của kẻ lười biếng! Trang 4 DẠNG 3: NHẬN BIẾT DUNG DỊCH ❖ Nhận biết các dd thường theo thứ tự sau: + Dùng quỳ tím nhận biết dd axit (quỳ tím hóa đỏ) hoặc dd bazơ (quỳ tím hóa xanh). + Các muối =SO4 nhận biết bằng các dd BaCl2, Ba(NO3)2, Ba(OH)2 (hoặc ngược lại) → tạo ↓ trắng. + Các muối –Cl nhận biết bằng muối AgNO3 (hoặc ngược lại) → tạo ↓ trắng. + Còn lại là muối – NO3. Câu 3: Nhận biết các dung dịch không màu sau bằng phương pháp hóa học: a) NaCl, NaOH, Na2SO4 NaNO3 b) NaNO3, KOH, Na2SO4, KCl c) BaCl2, NaOH, NaNO3, K2SO4 d) NaCl, Ba(OH)2, KNO3, Na2SO4 THCS Cát Lái – GV: Lê Hoàng Nam Trên bước đường thành công không có dấu chân của kẻ lười biếng! Trang 5 DẠNG 4:Có những bazơ sau: Fe(OH)2, NaOH, Cu(OH)2, KOH, Zn(OH)2, Mg(OH)2, Al(OH)3, Ca(OH)2, Fe(OH)3, Ba(OH)2 hãy cho biết bazơ nào bị phân hủy? Viết phương trình hóa học. DẠNG 5: BÀI TOÁN Tính nồng độ phần trăm (C%) dd tạo thành sau phản ứng. Cách tìm khối lượng dung dịch sau phản ứng: mdd sau phản ứng = ∑mchất cho vào – mchất kết tủa hoặc bay hơi Câu 5: Hòa tan 12 gam MgSO4 bằng dung dịch NaOH 10%. a. Tính khối lượng dung dịch NaOH cần dùng. b. Tính nồng độ phần trăm dung dịch muối sau phản ứng. c. Cho thêm dung dịch Ba(NO3)2 vào dung dịch A. Tính khối lượng kết tủa thu được. Câu 6: Hòa tan 16,1 gam ZnSO4 bằng dung dịch NaOH 20% thu được dung dịch A và kết tủa B a. Tính khối lượng dung dịch NaOH cần dùng. b. Tính nồng độ phần trăm dung dịch muối sau phản ứng. c. Cho thêm dung dịch BaCl2 vào dung dịch A. Tính khối lượng kết tủa thu được. THCS Cát Lái – GV: Lê Hoàng Nam Trên bước đường thành công không có dấu chân của kẻ lười biếng! Trang 6 Câu 7: Hòa tan 16 gam CuSO4 bằng dung dịch NaOH 20% thu được dung dịch A và kết tủa B. a. Tính khối lượng dung dịch NaOH cần dùng. b. Tính nồng độ phần trăm dung dịch muối sau phản ứng. c. Cho thêm dung dịch Ba(OH)2 vào dung dịch B. Tính khối lượng kết tủa thu được. Tính nồng độ mol (CM) dd tạo thành sau phản ứng. Thể tích dung dịch sau phản ứng: Vdd sau phản ứng = ∑Vdd tham gia phản ứng (không trừ ↑ , ↓) Câu 8: Cho 150ml dd BaCl2 2M tác dụng vừa đủ với 200ml dd Na2CO3. a. Tính khối lượng chất kết tủa thu được. b. Tính nồng độ mol của chất trong dd sau phản ứng. Cho rằng thể tích của dd thay đổi không đáng kể. c. Hòa tan hoàn toàn kết tủa trên bằng dd HCl 10% , tính khối lượng dung dịch HCl cần dùng. Câu 9: Cho 30ml dd CaCl2 2M tác dụng vừa đủ với 70 ml dd K2CO3. a. Tính khối lượng chất rắn sinh ra. b. Tính nồng độ mol của chất trong dd sau phản ứng. Cho rằng thể tích của dd thay đổi không đáng kể. c. Hòa tan hoàn toàn kết tủa trên bằng dd HCl 5% , tính khối lượng dung dịch HCl cần dùng.
File đính kèm:
 de_cuong_on_tap_kiem_tra_1_tiet_mon_hoa_hoc_lop_9_bai_bazo_v.pdf
de_cuong_on_tap_kiem_tra_1_tiet_mon_hoa_hoc_lop_9_bai_bazo_v.pdf

