Đề kiểm tra 45 phút bài số 2 môn Hóa học Lớp 9 (Có đáp án)
Phần 1. TRẮC NGHIỆM KHÁCH QUAN (2 điểm)
Hãy khoanh tròn một trong các chữ A, B, C, D đứng trước phương án chọn đúng:
Câu 1: Cho bazơ có công thức sau Fe(OH)2 ; oxit tương ứng của bazơ đó là:
| A. Fe3O4 | B. Fe2O3 | C. FeO | D. Fe3O2 |
Câu 2: Nguyên liệu để sản xuất NaOH trong công nghiệp là:
A.NaCl B. NaCl và O2 C. NaCl và H2 D. dung dịch NaCl bão hòa
Câu 3: Phân bón nào sau đây là phân đạm?
A. CO(NH2)2 B. Ca3(PO4)2 C. K2SO4 D. KCl
Câu 4: Muối nào sau đây tác dụng được với dung dịch KOH?
A. BaCl2 B. K2SO4 C. CuSO4 D. Tất cả
Phần 2. TỰ LUẬN (8,0 điểm)
Câu 1 (2,0 điểm). Nêu hiện tượng và viết phương trình hóa học cho những thí nghiệm sau :
a) Cho đinh sắt vào cốc đựng dd CuSO4
b) Cho dung dịch CuSO4 tác dụng với dung dịch NaOH
Câu 2 (3,0 điểm). Hoàn thành các phương trình hóa học sau (ghi rõ điều kiện nếu có):
a) NaOH + .................... Na2SO4 + H2O
b) .................. + Ca(OH)2 CaCO3 + KOH
c) Fe + ....................... ................ + Cu
d) BaCl2 + ..................... ..................... + NaCl
e) K2CO3 + ..................... KCl + ............... + ..............
f) ................. Al2O3 + H2O
Câu 3 (3,0 điểm).
Hòa tan 20 gam NaOH vừa đủ với 160 gam dung dịch CuSO4 . Sau khi phản ứng xảy ra hoàn toàn, thu được kết tủa A và dung dịch B. Lọc lấy kết tủa A rồi nung đến khối lượng không đổi được chất rắn C.
a) Viết phương trình hóa học xảy ra.
b)Tính khối lượng chất rắn C.
c) Tính nồng độ phần trăm của dung dịch CuSO4 ban đầu và dung dịch B
( Cho Cu = 64; S = 32 ; O = 16; Na = 23; H = 1 )
Tóm tắt nội dung tài liệu: Đề kiểm tra 45 phút bài số 2 môn Hóa học Lớp 9 (Có đáp án)
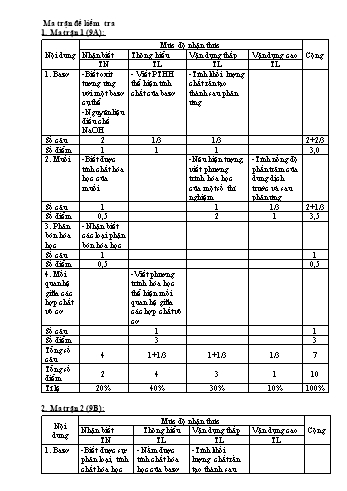
Ma trận đề kiểm tra 1. Ma trận 1 (9A): Nội dung Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao TN TL TL TL 1. Bazơ -Biết oxit tương ứng với một bazơ cụ thể -Nguyên liệu điều chế NaOH - Viết PTHH thể hiện tính chất của bazơ -Tính khối lượng chất rắn tạo thành sau phản ứng Số câu 2 1/3 1/3 2+2/3 Số điểm 1 1 1 3,0 2. Muối -Biết được tính chất hóa học của muối -Nêu hiện tượng, viết phương trình hóa học của một số thí nghiệm -Tính nồng độ phần trăm của dung dịch trước và sau phản ứng Số câu 1 1 1/3 2+1/3 Số điểm 0,5 2 1 3,5 3. Phân bón hóa học - Nhận biết các loại phận bón hóa học Số câu 1 1 Số điểm 0,5 0,5 4. Mối quan hệ giữa các hợp chất vô cơ -Viết phương trình hóa học thể hiện mối quan hệ giữa các hợp chất vô cơ Số câu 1 1 Số điểm 3 3 Tổng số câu 4 1+1/3 1+1/3 1/3 7 Tổng số điểm 2 4 3 1 10 Tỉ lệ 20% 40% 30% 10% 100% 2. Ma trận 2 (9B): Nội dung Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao TN TL TL TL 1. Bazơ -Biết được sự phân loại, tính chất hóa học của bazơ - Nắm được tính chất hóa học của bazơ tan -Tính khối lượng chất rắn tạo thành sau phản ứng Số câu 2 1/2 1/3 2+1/2+1/3 Số điểm 1 0,5 1,5 3 2. Muối -Biết được NaCl là thành phần chính của muối ăn - Viết PTHH của phản ứng giữa bazơ và muối -Nêu hiện tượng, viết PTHH của một số thí nghiệm -Tính nồng độ mol của dung dịch trước và sau phản ứng Số câu 1 1/3 1/2 1/3 1+1/2+2/3 Số điểm 0,5 0,5 1,5 1 3,5 3. Phân bón hóa học - Nhận biết được các loại phân bón Số câu 1 1 Số điểm 0,5 0,5 4. Mối quan hệ giữa các hợp chất vô cơ -Viết được các PTHH thẻ hiện mối quan hệ giữa các hợp chất vô cơ Số câu 1 1 Số điểm 3 3 Tổng số câu 4 1+ 1/2+1/3 1/2+ 1/3 1/3 7 Tổng số điểm 2 4 3 1 10 Tỉ lệ 20% 40% 30% 10% 100% Đề kiểm tra: Đề 1 (9A): Phần 1. TRẮC NGHIỆM KHÁCH QUAN (2 điểm) Hãy khoanh tròn một trong các chữ A, B, C, D đứng trước phương án chọn đúng: Câu 1: Cho bazơ có công thức sau Fe(OH)2 ; oxit tương ứng của bazơ đó là: A. Fe3O4 B. Fe2O3 C. FeO D. Fe3O2 Câu 2: Nguyên liệu để sản xuất NaOH trong công nghiệp là: A.NaCl B. NaCl và O2 C. NaCl và H2 D. dung dịch NaCl bão hòa Câu 3: Phân bón nào sau đây là phân đạm? A. CO(NH2)2 B. Ca3(PO4)2 C. K2SO4 D. KCl Câu 4: Muối nào sau đây tác dụng được với dung dịch KOH? A. BaCl2 B. K2SO4 C. CuSO4 D. Tất cả Phần 2. TỰ LUẬN (8,0 điểm) Câu 1 (2,0 điểm). Nêu hiện tượng và viết phương trình hóa học cho những thí nghiệm sau : a) Cho đinh sắt vào cốc đựng dd CuSO4 b) Cho dung dịch CuSO4 tác dụng với dung dịch NaOH Câu 2 (3,0 điểm). Hoàn thành các phương trình hóa học sau (ghi rõ điều kiện nếu có): a) NaOH + .................... Na2SO4 + H2O b) .................. + Ca(OH)2 CaCO3 + KOH c) Fe + ....................... ................ + Cu d) BaCl2 + ..................... ..................... + NaCl e) K2CO3 + ..................... KCl + ............... + .............. f) ................. Al2O3 + H2O Câu 3 (3,0 điểm). Hòa tan 20 gam NaOH vừa đủ với 160 gam dung dịch CuSO4 . Sau khi phản ứng xảy ra hoàn toàn, thu được kết tủa A và dung dịch B. Lọc lấy kết tủa A rồi nung đến khối lượng không đổi được chất rắn C. a) Viết phương trình hóa học xảy ra. b)Tính khối lượng chất rắn C. c) Tính nồng độ phần trăm của dung dịch CuSO4 ban đầu và dung dịch B ( Cho Cu = 64; S = 32 ; O = 16; Na = 23; H = 1 ) Đề 2 (9B): Phần 1. TRẮC NGHIỆM KHÁCH QUAN (2 điểm) Hãy khoanh tròn một trong các chữ A, B, C, D đứng trước phương án chọn đúng: Câu 1: Nhỏ 1 gọt dung dịch NaOH vào giấy quỳ tím thì quỳ tím chuyển sang màu: A. Màu xanh. B. Màu đỏ. C. Màu vàng D. Màu hồng. Câu 2: Dãy chất nào cho sau đây toàn là bazơ tan? A. NaOH, Cu(OH)2, Ba(OH)2 B. Cu(OH)2, Al(OH)3, Mg(OH)2 C. NaOH, Ba(OH)2, KOH D. Al(OH)3, Mg(OH)2, KOH Câu 3: Chất nào sau đây là phân đạm? A. KCl B. K2SO4 C. Ca3(PO4)2 D.CO(NH2)2 Câu 4. Muối ăn có thành phần chính là: A. NaCl B. KCl C. CaCl2 D. Na2SO4 Phần 2. TỰ LUẬN (8,0 điểm) Câu 1 (2,0 điểm). Nêu hiện tượng cho những thí nghiệm sau, viết phương trình hóa học xảy ra nếu có: a) Nhỏ dung dịch KOH vào giấy phenolphtalein màu trắng b) Cho dung dịch Na2SO4 tác dụng với dung dịch BaCl2 Câu 2 (3,0 điểm). Hoàn thành các phương trình hóa học sau (ghi rõ điều kiện nếu có): a) NaOH + .................... NaCl + H2O b) .................. + Ca(OH)2 CaCO3 + H2O c) Fe + CuSO4 ................ + .............. d) BaCl2 + ..................... BaSO4 + NaCl e) K2CO3 + HCl ............. + ............... + .............. f) ................. CuO + H2O Câu 3 (3,0 điểm). Hòa tan 40g CuSO4 vừa đủ với 200ml dung dịch NaOH thấy thu được chất rắn A và dung dịch B. a) Viết phương trình hóa học xảy ra. b) Tính khối lượng chất rắn A c) Tính nồng độ mol của dung dịch NaOH ban đầu và dung dịch sau phản ứng (Coi thể tích dung dịch thay đổi không đáng kể trong quá trình phản ứng) (Cho Cu = 64; S = 32 ; O = 16; Na = 23; H = 1 ) Đáp án và biểu điểm: Đề 1 (9A): Câu Đáp án Điểm Phần 1. TRẮC NGHIỆM KHÁCH QUAN (2 điểm) 1 2 3 4 C D A C 0,5 0,5 0,5 0,5 Phần 2. TỰ LUẬN (8 điểm) 1 (2 điểm) a) Cho đinh sắt vào cốc đựng dd CuSO4 HT : Có chất rắn màu đỏ bám vào đinh sắt, màu xanh của dung dịch nhạt dần PTHH : Fe + CuSO4 FeSO4 + Cu b) Cho dung dịch CuSO4 tác dụng với dung dịch NaOH HT : Xuất hiện kết tủa màu xanh lơ PTHH : CuSO4 + 2NaOH Cu(OH)2 + Na2SO4 0,5 0,5 0,5 0,5 2 (3 điểm) a) 2NaOH + H2SO4 Na2SO4 + 2 H2O b) K2CO3 + Ca(OH)2 CaCO3 + 2KOH c) Fe + CuSO4 FeSO4 + Cu d) BaCl2 + Na2SO4 BaSO4 + 2NaCl e) K2CO3 + 2HCl 2KCl + CO2 + H2O f) 2Al(OH)3 Al2O3 + 3H2O 0,5 0,5 0,5 0,5 0,5 0,5 3 (3 điểm) a) Phương trình: CuSO4 + 2NaOH ® Cu(OH)2¯ + Na2SO4 (1) Kết tủa sau phản ứng là Cu(OH)2 ; dung dịch B : Na2SO4 Cu(OH)2¯ CuO + H2O (2) Chất rắn C: CuO 0,5 0,5 b) Ta có: nNaOH= = 0,5 mol Theo (1)và (2): nCuO = = = 0,25 mol mCuO = 0,25.80 = 20 g 0,25 0,5 0,25 c) Theo (1) ta có: = = 0,25 mol ® = 0,25 . 160 = 40 g C%= . 100% = 25% Theo (1) ta có: tạo ra = = 0,25 mol ® tạo ra= 0,25 . 142 = 35,5 g Có: = 0,25 . 98 = 24,5 ® mdung dịch sau phản ứng = ( 20 + 160 ) – 24,5 = 154,5 g Vậy: C%tạo ra= . 100% 23% 0,5 0,5 Đề 2 (9B): Câu Đáp án Điểm Phần 1. TRẮC NGHIỆM KHÁCH QUAN (2 điểm) 1 2 3 4 A B D A 0,5 0,5 0,5 0,5 Phần 2. TỰ LUẬN (8 điểm) 1 (2 điểm) a) Nhỏ dung dịch KOH vào giấy phenolphtalein màu trắng HT : Giấy phenolphtalein chuyển sang màu đỏ b) Cho dung dịch Na2SO4 tác dụng với dung dịch BaCl2 HT : Xuất hiện kết tủa trắng PTHH : Na2SO4 + BaCl2 2NaCl + BaSO4 0,5 0,5 1 2 (3 điểm) a) NaOH + HCl NaCl + H2O b) CO2 + Ca(OH)2 CaCO3 + H2O c) Fe + CuSO4 FeSO4 + Cu d) BaCl2 + Na2SO4. BaSO4 + 2NaCl e) K2CO3 + 2HCl 2KCl + CO2 + H2O f) Cu(OH)2 CuO + H2O 0,5 0,5 0,5 0,5 0,5 0,5 3 (3 điểm) a) Phương trình: CuSO4 + 2NaOH ® Cu(OH)2¯ + Na2SO4 (1) Chất rắn A là Cu(OH)2 0,5 b) Ta có: = = 0,25 mol Theo phương trình hóa học: = = 0,25 mol 0,5 0,5 0,5 c) Theo PTHH ta có: = 2 = 0,5 mol Theo (1) ta có: tạo ra = = 0,25 mol 0,25 0,25 0,25 0,25
File đính kèm:
 de_kiem_tra_15_phut_so_2_mon_hoa_hoc_lop_9_co_dap_an.doc
de_kiem_tra_15_phut_so_2_mon_hoa_hoc_lop_9_co_dap_an.doc

